推荐产品
公司新闻/正文
影响因子24.633文献解读之内皮来源的基质细胞有助于造血骨髓生态位的形成
人阅读 发布时间:2023-05-25 14:54
Endothelium-derived stromal cells contribute to hematopoietic bone marrow niche formation
内皮来源的基质细胞有助于造血骨髓生态位的形成

期刊名:Cell Stem Cell;
影响因子/JCR分区:24.633/Q1;
发表时间:2021年2月
骨髓基质细胞(BMSCs),又称骨髓间充质干细胞,是成体骨髓中的一类异质性多能干细胞群体,主要功能是维持组织稳态和驱动损伤后的组织再生。一般认为,在发育过程中骨髓中存在一类特异性的基质干细胞池,它们可以进一步分化为骨髓基质细胞。
随着发育完全,基质细胞的骨髓组织池大小是否受到限制?在组织损伤情况下,骨髓基质细胞可以重新形成?不同条件下形成的骨髓基质细胞是否来源不同呢?
(1)内皮细胞(ECs)是损伤后最早出现在骨髓中的细胞之一;
(2)先前鉴定出的一类CD31+CD9+CD105+人类再生相关ECs(hRECs)出现在胎儿发育和化疗后的再生过程中(血管生成、造血和成骨紧密结合时期);
(3)内皮细胞可以在相关诱导因子下发生间质化(EndMT),逐步丧失内皮特性,获得间质细胞或成纤维细胞表型。
科学假说:特定的内皮细胞群hRECs通过EndMT分化为BMSCs,是组织再生过程中重要的细胞来源。
2018年,作者在人类胎儿发育和损伤后的骨髓再生中发现一种独特的CD105 (endoglin)+内皮细胞(ECs)亚群,又叫人类再生相关的内皮细胞(hRECs)。对这些ECs进行转录组分析发现,一些与基质细胞命运相关的转录本,如THY1(CD90)和NGFR(CD271)大量表达。
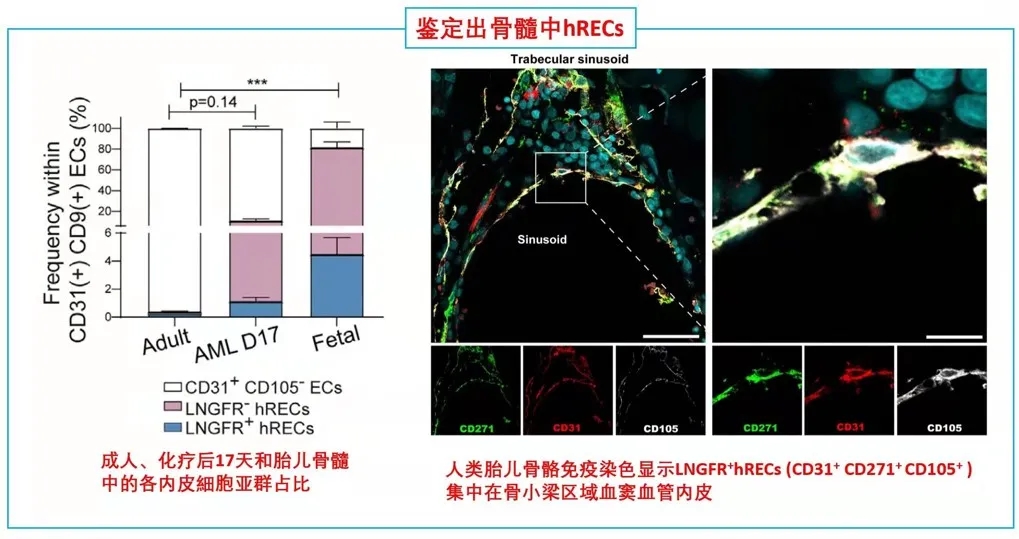
于是推测,在人类胚胎发育过程中可能存在一个具有基质细胞特性的hRECs亚群,其中LNGFR(由NGFR编码的蛋白)是已知的人类原代骨髓基质细胞标记物(研究切入点)。后续研究发现这类LNGFR+ EC并不存在成年人骨髓当中,却在胎儿骨髓和急性白血病患者化疗17天后骨髓(AML17)中大量存在。人类胎儿骨骼共聚焦成像进一步显示,位于小梁区域的窦状内皮中存在CD31+CD271+CD105+细胞。
这些数据表明,一种稀有的LNGFR+ ECs存在于人类骨骼和骨髓中,在发育和再生过程中出现频率显著增加。
骨髓基质细胞(BMSCs)在组织的维持和再生中起着至关重要的作用,但它们的起源仍然不完全清楚。
本研究在人类胚胎和再生骨髓中鉴定出一类稀有LNGFR+(CD271+)细胞,它们共同表达内皮细胞和基质细胞标记物。这种内皮细胞亚群表现出与内皮-间充质转化(EndMT)一致的转录重编程,并可在移植时生成具有重建骨髓(BM)生态的多能基质细胞。
随后通过小鼠的单细胞转录组学和谱系追踪证实了这类内皮亚群通过EndMT为骨前体生成和造血生态池提供重要细胞来源。最后发现了白细胞介素-33 (IL-33)在这类EndMT细胞亚群中显著高表达,并通过ST2受体信号驱动这一转换过程。

1、人类胚胎和再生骨髓中鉴定出一类稀有的LNGFR+细胞,同时具有内皮和基质细胞特性
由于这类内皮细胞共表达内皮细胞和间质标记物,提示它们可能发生了EndMT,即内皮细胞向基质细胞表型的转变。随后作者分选出CD31-LNGFR+BMSCs,LNGFR-hRECs和 LNGFR+ hRECs, 对他们进行转录组测序。

PCA分析发现内皮细胞和基质细胞群体明显存在独立聚类。
其中,LNGFR+hRECs聚集在LNGFR-hRECs和CD31-LNGFR+基质细胞之间;随后对它们转录本表达丰度分析发现LNGFR+hRECs与LNGFR-hRECs相比较内皮基因明显下调,而基质细胞标记基因明显上调;GSEA分析得出EndMT相关基因在LNGFR+hRECs中是显著富集的;同样一些重要关键的EndMT调节因子也在LNGFR+hRECs显著表达。
这些数据表明:LNGFR+hRECs具有与发生间质转化的ECs一致的分子特征,并可能具有原始间质细胞分化潜能。
2、LNGFR+ hRECs通过EndMT生成eBMSCs,具备多向分化潜能
在鉴定完LNGFR+ hRECs的存在,并提出假设其可能通过EndMT分化为BMSCs。随后,需要设计相关实验去证实这一猜想。首先,作者将分选出的LNGFR+ hRECs在体外进行诱导培养,这些细胞表现出多能基质细胞的特性(比如形成纤维细胞集落形成单位,CFU-F),并且可以进一步诱导分化为成骨、软骨、脂肪和造血干细胞等。
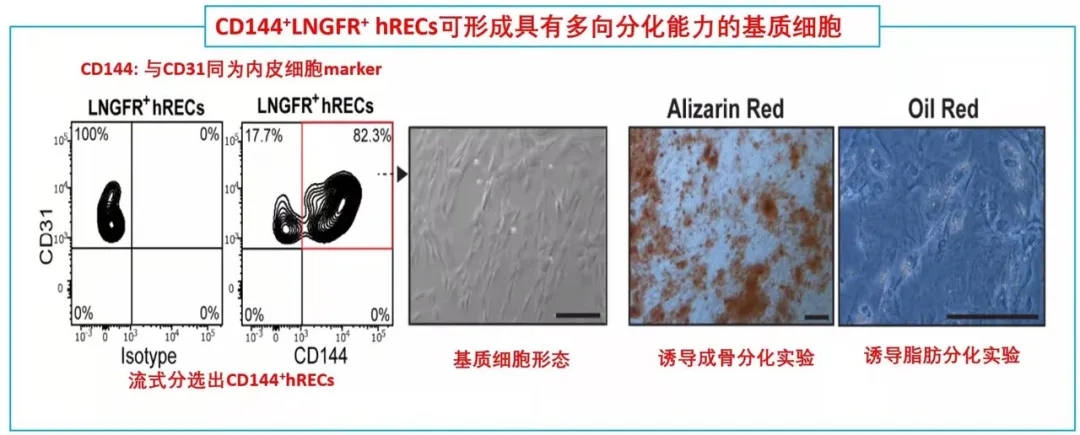
这就提示着,LNGFR+ hRECs具有转化为基质干细胞样细胞的能力,推测这些细胞具备分化成各类骨系细胞、支持新生造血等潜能,从而参与骨髓发育。
由胎骨分离的eBMSCs在软骨细胞培养基中培养三周后能形成软骨颗粒。作者将培养形成的软骨颗粒植入无胸腺裸鼠皮下。十周后,对裸鼠进行显微计算机断层扫描和组织学分析,作者发现,收获的小球中存在异位听骨、骨、软骨、脂肪细胞、血管和造血组织的形成。随后作者使用人源GAPDH抗体进行免疫组化染色进一步证实了骨细胞、软骨细胞、骨髓间充质干细胞和脂肪细胞的来源于eBMSCs。
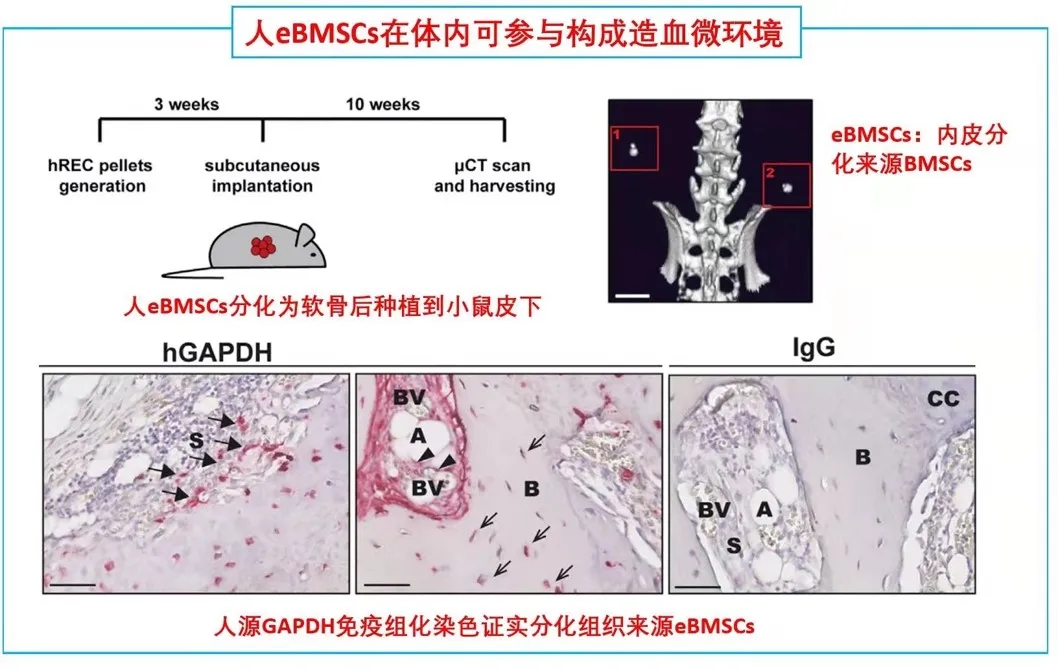
这些数据提示:LNGFR+EC来源的基质细胞群能够在体内进行多向成骨分化和形成造血微环境能力。
3. eBMSCs是造血微环境细胞群中一类独特亚群
由于单细胞测序是比较细胞亚群内在联系的重要手段。因此,作者从17天胎龄的小鼠胚胎中分选出内皮细胞和BMSCs进行scRNA-seq分析,发现存在一类同时表达内皮和基质特异性基因的细胞群,并且这类细胞富集表达EndMT相关基因。接下来,为了进一步证实EndMT细胞群确实来源于ECs并且是BMSCs分化过程中的中间态这一猜想,作者对这群细胞进行了拟时态轨迹分析。
结果发现EndMT细胞(图中细胞簇4)大多富集于位于ECs和BMSCs之间的分支,这支持了作者的猜想。
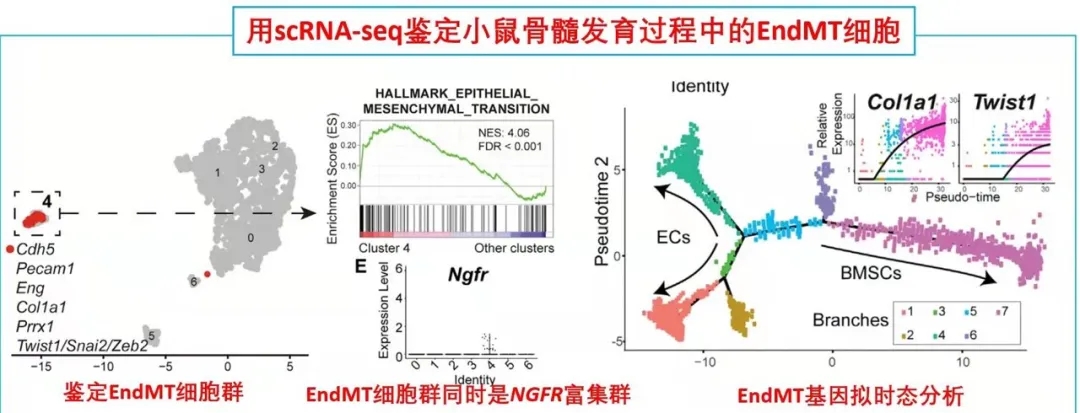
接下来,作者通过使用内皮细胞谱系示踪工具鼠(VECad-Cre;LoxP-tdTomato)揭示了BMSCs来源于ECs,同时还鉴定出成骨/软骨谱系细胞(OLCs)也来源于ECs。随后RNA-seq比较了各亚群(ECs来源或非来源的BMSCs和OLCs)转录本差异进一步支持了作者的发现。综上得出:在小鼠骨髓中存在一群内皮细胞来源的基质细胞亚群,它们表达着一些重要的造血干细胞调控因子,有助于成骨和造血微环境形成。
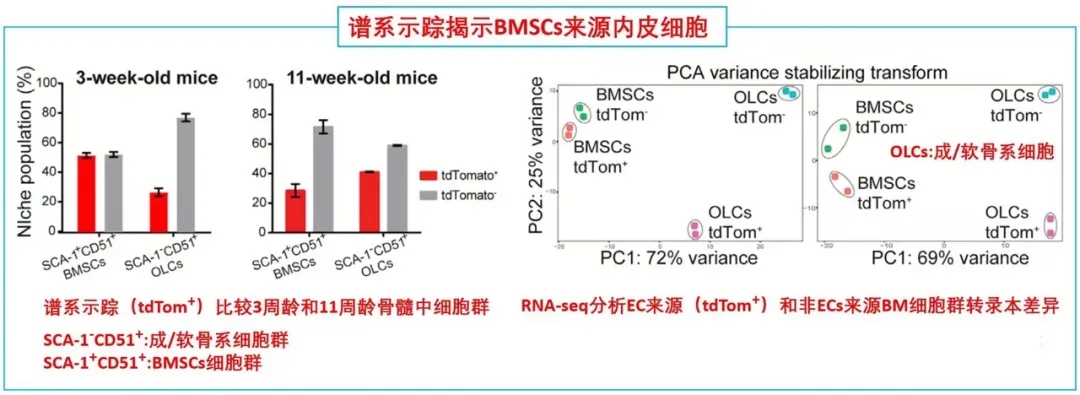
这就证实了人类LNGR+eBMSCs具有成骨和骨髓组织、支持造血的潜力。
4. IL-33通过诱导内皮细胞EndMT 分化为eBMSCs
文章到此,故事基本算是圆满,但全文并未涉及到机制层面的研究,于是作者进一步探索了EndMT机制,即:IL-33- ST2-SNAI2。

1)IL-33是作者实验室之前就研究过的,能够参与到造血、血管生成、成骨合成、骨髓再生和发育的过程中;
2)IL-33在发育和再生的ECs中高表达;
3)IL-33-ST2-SNAI2已经报道参与EndMT;
4)SNAI2在LNGFR+hRECs上调的EndMT调节因子中表达最高(与之前结果1呼应)。
首先作者发现IL-33在LNGFR+hRECs中显著高表达,随后分别在2种内皮细胞系中进行了论证,IL-33能够诱导EndMT,相关EndMT基因都显著上调;此外作者还证实了IL-33诱导的ECs具有BMSCs特性,也做了一些BMSCs相关的实验进行论证。关于ST2-SNAI2的机制验证,由于是基于已经证实的研究机制,因此作者只是简单的设计了一个小实验求证,即使用中和抗体封闭ST2,阻断了IL-33诱导的EndMT过程(补充材料)。
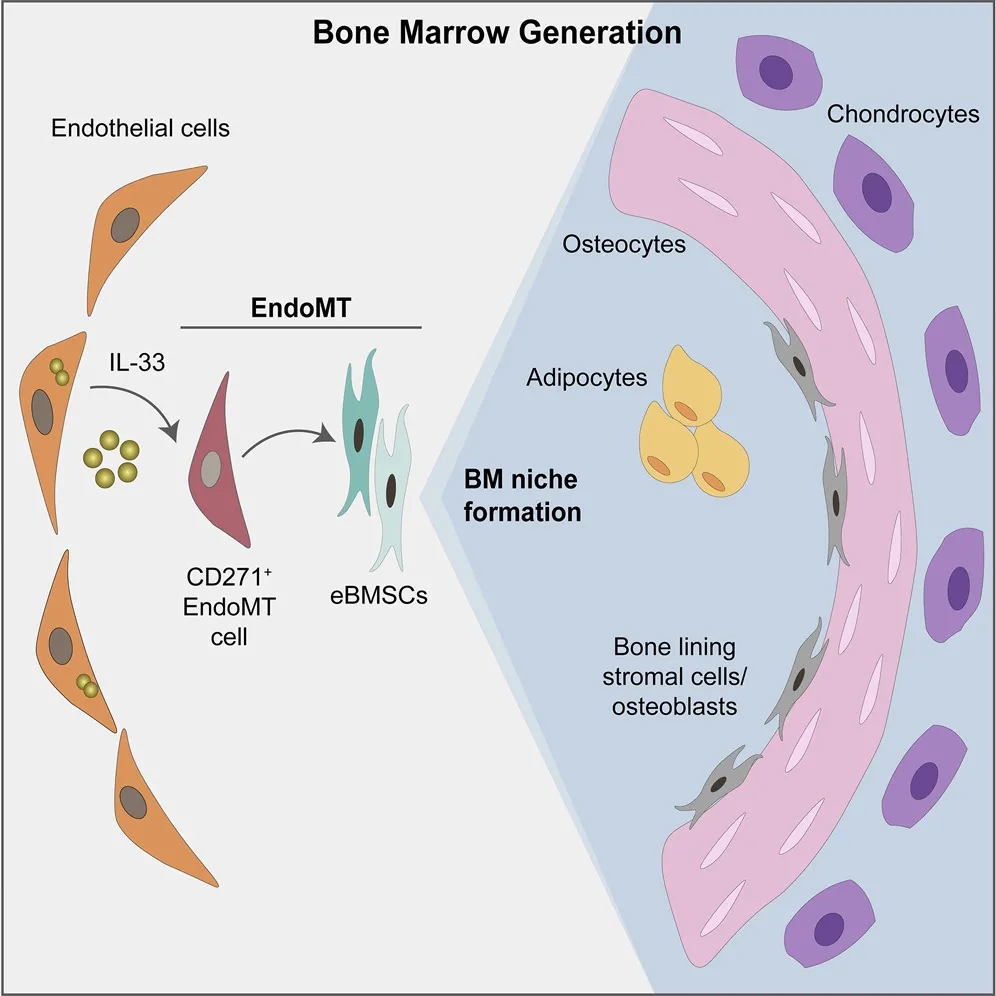
结论:骨髓LNGFR+hRECs内皮亚群在IL-33等诱导因素下发生EndMT,分化为具备干细胞特性的BMSCs,在骨组织发育、再生以及构建骨髓造血微环境中提供重要细胞来源。
1、本研究首次揭示了骨髓间质细胞BMSCs在组织修复/再生状态下能够从内皮细胞转化而来,并发现了骨髓内皮细胞可在IL-33诱导下发生EndMT,进而参与组织修复、造血等过程。内皮细胞可以“再分化”为干细胞特性的BMSCs,无疑打破传统认知,“体细胞诱导多能性干细胞潜能”的想法确实很新颖,为此作者花了大量实验去解释LNGFR+ hRECs如何分化为BMSCs,并提供了充实的证据,其在机制层面文笔不多,相关深层机制或许可以进一步挖掘。
2、基于作者结论“内皮细胞--BMSCs--其他组织细胞”,是否可以通过基因编辑手段改造内皮细胞,使其分为BMSCs?eBMSCs会通过血液循环参与其他疾病损伤的组织修复么?IL-33体外能够诱导EndMT,且作者提到在一些纤维化疾病中显著表达,那么其在纤维化疾病发生中的角色又是怎样?这些问题需要作者进一步的深入研究;

以上文献涉及的实验技术,均可在晶莱生物展开。
【晶莱生物】是一家专注于生物医学领域内科研学术服务的高新技术企业,致力于打造国内Yi流的生物技术服务品牌。为生物医学研究者提供动物造模、细胞生物学、基因组学、蛋白鉴定及分析、病理组化、表观遗传学等多个实验平台服务。